![]() Smelting-fast til væske
Smelting-fast til væske ![]() Smeltepunkt av rene og urene stoffer
Smeltepunkt av rene og urene stoffer
![]() Frysing-flytende til fast
Frysing-flytende til fast ![]() Smeltepunkt
Smeltepunkt
 Smelting og frysing se tilstandsendringer som oppstår når de faste og flytende tilstandene byttes ut. Smelting oppstår når et fast stoff oppvarmes og blir til en væske og frysing oppstår når en væske avkjøles og blir til et fast stoff.
Smelting og frysing se tilstandsendringer som oppstår når de faste og flytende tilstandene byttes ut. Smelting oppstår når et fast stoff oppvarmes og blir til en væske og frysing oppstår når en væske avkjøles og blir til et fast stoff.
Smelting – fast til flytende
når et fast stoff oppvarmes, får partiklene nok energi til å overvinne bindingskreftene som holder dem fast på plass. De begynner å bevege seg rundt, men holder seg nær sine nabopartikler og ruller rundt hverandre. Denne partikkelbevegelsen gjør at stoffet kan strømme og danne en væske. Faste stoffer og væsker er like i dens tetthet, det vil si antall partikler per volumenhet. De adskiller seg bare i væskens evne til å strømme og forandre form for å oppta formen på bunnen av beholderen.
 |
Partikler under smelting |
Smeltepunkt for rene og urene stoffer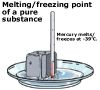 for rene stoffer er temperaturen der smelting og frysing oppstår ganske skarp og kalles stoffets smeltepunkt. For urene stoffer oppstår smelting og frysing mer gradvis over en rekke temperaturer. Dette er en måte at kjemikere identifiserer renheten av et stoff; en ren substans vil smelte ved en innstilt temperatur, mens jo mer uren et stoff er, desto mer vil smeltepunktet variere over en rekke temperaturer.
for rene stoffer er temperaturen der smelting og frysing oppstår ganske skarp og kalles stoffets smeltepunkt. For urene stoffer oppstår smelting og frysing mer gradvis over en rekke temperaturer. Dette er en måte at kjemikere identifiserer renheten av et stoff; en ren substans vil smelte ved en innstilt temperatur, mens jo mer uren et stoff er, desto mer vil smeltepunktet variere over en rekke temperaturer.
 Frysing-væske til fast stoff
Frysing-væske til fast stoff
Frysing oppstår når en væske avkjøles og blir til et fast stoff. Ved avkjøling mister partiklene i en væske energi, slutter å bevege seg og bosette seg i et stabilt arrangement, og danner et fast stoff. Frysing skjer ved samme temperatur som smelting, derfor er smeltepunktet og frysepunktet til et stoff den samme temperaturen. Smeltepunktet / frysepunktet til et stoff er definert som temperaturen over hvilken stoffet er flytende og under hvilket det er fast.
 |
Frysing |
Smeltepunkter
forskjellige faste stoffer har forskjellige smeltepunkter avhengig av styrken av bindingen mellom partiklene og massen av partiklene. I hovedsak er jo tyngre partiklene i det faste stoffet, og jo sterkere bindingen, desto høyere smeltepunkt.
Helium, den letteste og svakeste bundet stoff kjent, har et smeltepunkt svært nær det absolutte nullpunkt, eller – 273°C. I den andre enden av skalaen, Wolfram, laget av mye tyngre partikler med meget sterk binding, smelter på 3410°C.
| Opphavsrett eid Av Staten Victoria (Department Of Education And Early Childhood Development). Brukes Med Tillatelse. |