![]() smältning-fast till flytande
smältning-fast till flytande ![]() smältpunkt för rena och orena ämnen
smältpunkt för rena och orena ämnen![]() frysning-flytande till fast
frysning-flytande till fast ![]() smältpunkter
smältpunkter
 smältning och frysning se tillståndsändringar som uppstår när fasta och flytande tillstånd växlar. Smältning sker när ett fast ämne värms upp och förvandlas till en vätska och frysning sker när en vätska kyls och förvandlas till ett fast ämne.
smältning och frysning se tillståndsändringar som uppstår när fasta och flytande tillstånd växlar. Smältning sker när ett fast ämne värms upp och förvandlas till en vätska och frysning sker när en vätska kyls och förvandlas till ett fast ämne.
smältande – fast till flytande
när ett fast ämne värms upp får partiklarna tillräckligt med energi för att övervinna bindningskrafterna som håller dem ordentligt på plats. De börjar röra sig, men håller sig nära sina närliggande partiklar och rullar runt varandra. Denna partikelrörelse gör att ämnet kan strömma och bilda en vätska. Fasta ämnen och vätskor är lika i densitet, det vill säga antal partiklar per volymenhet. De skiljer sig endast i vätskans förmåga att flöda och ändra form för att uppta formen på behållarens nedre del.
 |
partiklar under smältning |
smältpunkt för rena och orena ämnen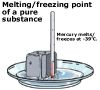 för rena ämnen är temperaturen vid vilken smältning och frysning sker ganska skarp och kallas ämnets smältpunkt. För orena ämnen sker smältning och frysning mer gradvis över ett temperaturområde. Detta är ett sätt att kemister identifierar renheten hos ett ämne; en ren substans smälter vid en inställd temperatur medan ju mer oren ett ämne är, desto mer kommer dess smältpunkt att variera över ett temperaturområde.
för rena ämnen är temperaturen vid vilken smältning och frysning sker ganska skarp och kallas ämnets smältpunkt. För orena ämnen sker smältning och frysning mer gradvis över ett temperaturområde. Detta är ett sätt att kemister identifierar renheten hos ett ämne; en ren substans smälter vid en inställd temperatur medan ju mer oren ett ämne är, desto mer kommer dess smältpunkt att variera över ett temperaturområde.
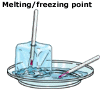 frysning – vätska till fast
frysning – vätska till fast
frysning uppstår när en vätska kyls och förvandlas till en fast substans. Vid kylning förlorar partiklarna i en vätska energi, slutar röra sig och sätter sig i ett stabilt arrangemang och bildar ett fast ämne. Frysning sker vid samma temperatur som smältning, följaktligen är smältpunkten och fryspunkten för ett ämne samma temperatur. Smält – / fryspunkten för ett ämne definieras som den temperatur över vilken ämnet är flytande och under vilken det är fast.
 |
frysning |
smältpunkter
olika fasta ämnen har olika smältpunkter beroende på bindningsstyrkan mellan partiklarna och partiklarnas massa. I huvudsak är ju tyngre partiklarna i det fasta ämnet, och ju starkare bindningen desto högre smältpunkt.
Helium, det lättaste och svagaste bundna ämnet som är känt, har en smältpunkt mycket nära absolut noll, eller – 273 kcal C. I den andra änden av skalan smälter volfram, Tillverkad av mycket tyngre partiklar med mycket stark bindning, vid 3410 kcal C.
| upphovsrätt som ägs av staten Victoria (Department of Education and Early Childhood Development). Används med tillstånd. |