![]() topire-solid la lichid
topire-solid la lichid ![]() punctul de topire al substanțelor pure și impure
punctul de topire al substanțelor pure și impure
![]() congelare-lichid la solid
congelare-lichid la solid ![]() puncte de topire
puncte de topire
 topire și înghețare consultați modificările de stare care apar atunci când se schimbă stările solide și lichide. Topirea are loc atunci când un solid este încălzit și se transformă într-un lichid, iar înghețarea are loc atunci când un lichid este răcit și se transformă într-un solid.
topire și înghețare consultați modificările de stare care apar atunci când se schimbă stările solide și lichide. Topirea are loc atunci când un solid este încălzit și se transformă într-un lichid, iar înghețarea are loc atunci când un lichid este răcit și se transformă într-un solid.
topire – solid în lichid
când un solid este încălzit, particulele sale câștigă suficientă energie pentru a depăși forțele de legătură care le țin ferm în poziție. Încep să se miște, dar rămân aproape de particulele vecine, rostogolindu-se unul în jurul celuilalt. Această mișcare a particulelor permite substanței să curgă și să formeze un lichid. Solidele și lichidele sunt similare în densitatea lor, adică numărul de particule pe unitate de volum. Ele diferă numai în capacitatea lichidului de a curge și de a schimba forma pentru a ocupa forma părții inferioare a recipientului său.
 |
particule în timpul topirii |
punctul de topire al substanțelor pure și impure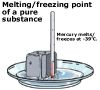 pentru substanțele pure, temperatura la care are loc topirea și înghețarea este destul de ascuțită și se numește punctul de topire al substanței. Pentru substanțele impure, topirea și înghețarea apar mai treptat într-un interval de temperatură. Acesta este un mod prin care chimiștii identifică puritatea unei substanțe; o substanță pură se va topi la o temperatură setată, în timp ce cu cât o substanță este mai impură, cu atât punctul său de topire va varia într-un interval de temperaturi.
pentru substanțele pure, temperatura la care are loc topirea și înghețarea este destul de ascuțită și se numește punctul de topire al substanței. Pentru substanțele impure, topirea și înghețarea apar mai treptat într-un interval de temperatură. Acesta este un mod prin care chimiștii identifică puritatea unei substanțe; o substanță pură se va topi la o temperatură setată, în timp ce cu cât o substanță este mai impură, cu atât punctul său de topire va varia într-un interval de temperaturi.
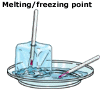 congelare – lichid la solid
congelare – lichid la solid
înghețarea are loc atunci când un lichid este răcit și se transformă într-un solid. La răcire, particulele dintr-un lichid pierd energie, se opresc din mișcare și se așează într-un aranjament stabil, formând un solid. Înghețarea are loc la aceeași temperatură ca topirea, prin urmare, punctul de topire și punctul de îngheț al unei substanțe sunt aceeași temperatură. Punctul de topire/congelare al unei substanțe este definit ca temperatura peste care, substanța este lichidă și sub care, este solidă.
 |
congelare |
punctele de topire
diferitele solide au puncte de topire diferite în funcție de rezistența legăturii dintre particule și masa particulelor. În esență, cu cât particulele sunt mai grele în solid și cu cât legătura este mai puternică, cu atât este mai mare punctul de topire.
heliul, cea mai ușoară și cea mai slabă substanță legată cunoscută, are un punct de topire foarte aproape de zero absolut, or – 273 C. la celălalt capăt al scalei, tungstenul, format din particule mult mai grele, cu legături foarte puternice, se topește la 3410 C.
| drepturi de autor deținute de statul Victoria (Departamentul Educației și dezvoltării timpurii). Folosit cu permisiune. |